Азотная кислота или HNO3 - сильный электролит, широко используемый в химической промышленности. Она представляет собой прозрачную жидкость, которая может иметь желтоватый оттенок при условии её длительного хранения в теплом помещении.
При нагревании она приобретает бурый цвет из-за процесса выделения (NO) диоксида азота. Форма выпуска кислоты зависит от ее концентрации: обычная - при 65%; дымная – от 86%. Азотная кислота широко применяется в лабораториях и научных исследованиях, используется в аграрном хозяйстве, производстве взрывчатых веществ, лекарств и красителей. Так, например, в результате нейтрализации азотной кислоты аммиаком образуется нитрат аммония – важнейший компонент минеральных удобрений, используемых во всем мире. А в ювелирном деле с помощью вещества определяют массовую долю золота в сплаве.
Химические свойства:
Азотная кислота имеет сильные окислительные свойства за счет азота N (+5) и проявляет себя по особой схеме в концентрированном и разбавленном состоянии. Вступает в реакцию с металлами (кроме платины, золота, радия и др) и со многими другими веществами. При растворении выделяет тепло, поэтому значительная часть реакций с ее участием опасна и требует соблюдения мер осторожности.
Так, в реакциях с насыщенным раствором мы получаем оксиды азота или пассивацию металла:
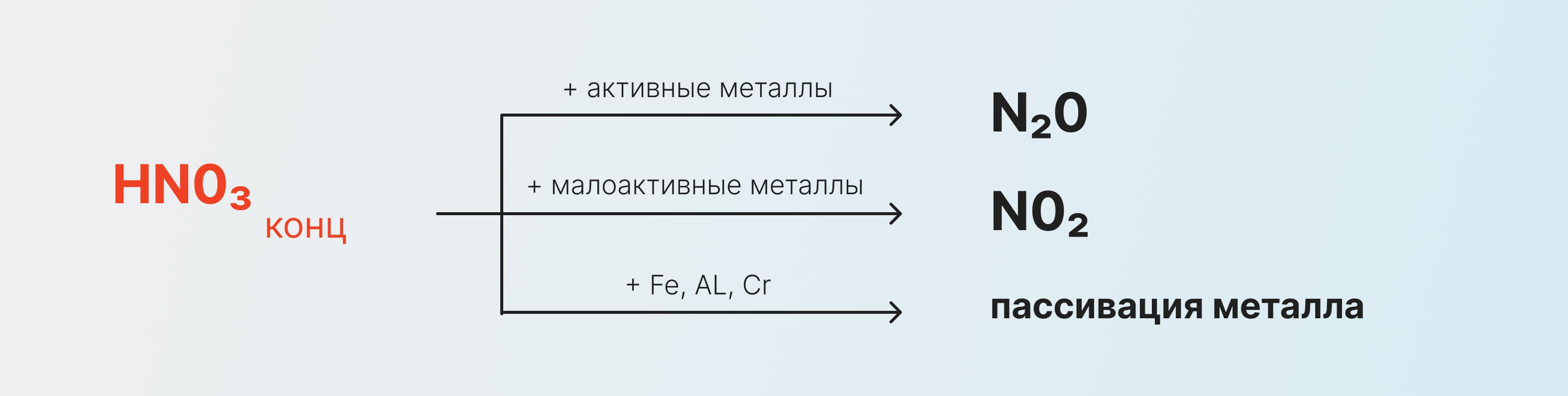
Слабый кислотный раствор же реагирует иначе и образуется нитрат аммония или несолеобразующий оксид:
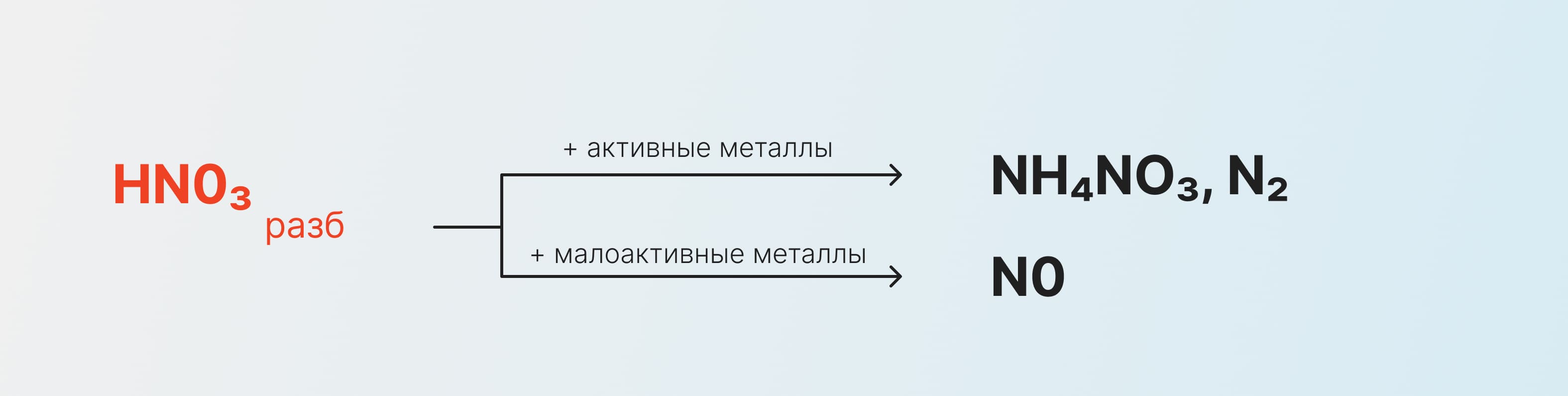
Получение азотной кислоты:
В настоящее время в коммерческих целях основным методом получения азотной кислоты является окисление аммиака в несколько этапов:
- Процесс каталитического окисления синтетического аммиака;
- Получение смеси нитрозных газов;
- Впитывание воды;
- Процесс концентрирования азотной кислоты.
В лабораториях чистую азотную кислоту получают при воздействии концентрированной серной кислоты на твердые нитраты металлов. При этом менее летучая серная кислота вытесняет более летучую азотную.
Применение азотной кислоты:
Сфера применения в различных отраслях обширна в настоящее время:
- Химическая. Изготовление взрывчатых веществ, органических красителей, пластмасс, калия, искусственного волокна. В результате окисления образуется адипиновая кислота, которая широко распространена в изготовлении нейлона.
- Сельскохозяйственная. Производство минеральных удобрений и селитры.
- Ювелирная отрасль. Определение чистоты драгоценных металлов и сплавов.
- Ракетно-космическая отрасль. HNO3 - одна из составляющих ракетного топлива. Основными компонентами смеси которого являются HNO3, тетроксид диазота и перекись водорода.
- Фармакологическая отрасль. Входит в состав препаратов по удалению кожных образований.
Защита при работе с концентрированной азотной кислотой.
 Взрывоопасный характер реакций и образующихся соединений требует строгого подхода в хранении и использовании раствора во избежание опасности для здоровья. Контактирующий обязан быть в респираторе, защитных очках и в кислостойкой одежде. После работы с соединениями рекомендуется вымыть руки и лицо и воспользоваться барьерным кремом. В соответствии с правилами ДОПОГ азотную кислоту стоит перевозить в алюминиевых цистернах или в емкостях с соответствующей маркировкой. Азотная кислота пассивирует хром, железо, алюминий, так как они покрыты оксидной пленкой.
Взрывоопасный характер реакций и образующихся соединений требует строгого подхода в хранении и использовании раствора во избежание опасности для здоровья. Контактирующий обязан быть в респираторе, защитных очках и в кислостойкой одежде. После работы с соединениями рекомендуется вымыть руки и лицо и воспользоваться барьерным кремом. В соответствии с правилами ДОПОГ азотную кислоту стоит перевозить в алюминиевых цистернах или в емкостях с соответствующей маркировкой. Азотная кислота пассивирует хром, железо, алюминий, так как они покрыты оксидной пленкой.
Для хранения используются специализированные емкости, устойчивые к ее воздействию. Они закрыты надлежащим образом и хранятся вдали от прямых солнечных лучей в хорошо проветриваемых помещениях. Также для хранения соединения используют бутыли из лабораторного стекла.


 С наступающим Новым годом!
С наступающим Новым годом!